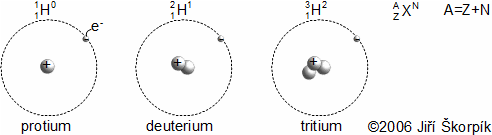
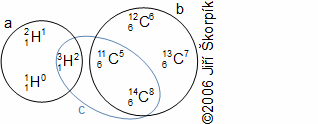
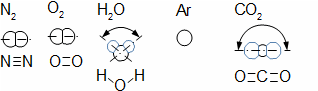
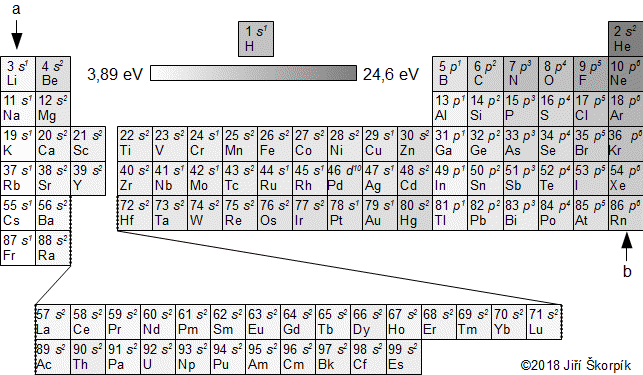
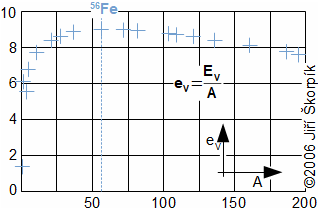
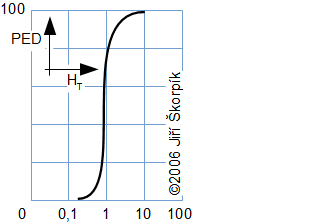
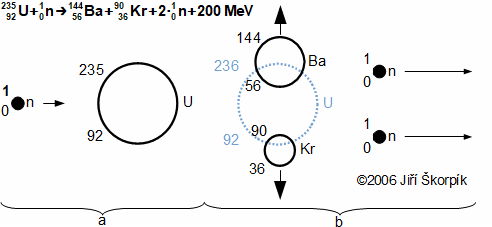
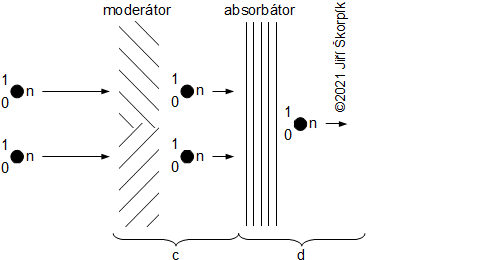
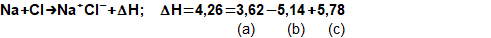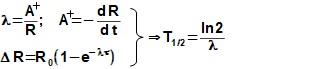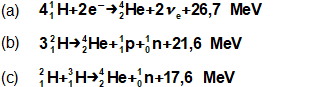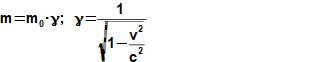složen – hmotnost atomu bude větší o ekvivalent vazebné energie jádra kinetických energií částic. Naopak, při malých energiií chemických vazeb se rozdíl mezi hmotností vstupních produktů a výsledné sloučeniny prakticky neprojeví, respektive je velmi malý a při výpočtech se s úbytkem hmotnosti nepočítá.
Hmota se může zcela transformovat na energii
Zcela se projeví vztah mezi hmotou a energií při anihilaci – sloučení hmoty a antihmoty, při kterém dojde k přeměně obou podle rovnice E=m·c2 na energii (kde E [J] je množství uvolněné energie; m [kg] celková hmotnost anihilované hmoty), energie je uvolněna ve formě fotonů, tedy elektromagnetického záření. Antihmotou je například pozitron e+, který je antičásticí (antihmotou) k elektronu e- známého z běžné hmoty.
Odkazy
ŠKORPÍK, Jiří, 2019, Foton, Transformační technologie, Brno, [on-line], ISSN 1804-8293. Dostupné z https://www.transformacni-technologie.cz/46.html.
ŠKORPÍK, Jiří, 2020, Z dějin transformačních technologií, Transformační technologie, Brno, [online], [cit. 2022-01-25], ISSN 1804-8293. Dostupné z https://www.transformacni-technologie.cz/01.html.
ŠKORPÍK, Jiří, 2022, Jaderná energetika, Transformační technologie, Brno, [online], ISSN 1804-8293. [cit. 2022-01-25], Dostupné z https://www.transformacni-technologie.cz/jaderna-energetika_2022.html.
ASIMOV, Isaac, 1978, Slova vědy-co se za nimi skrývá, Panorama, Praha. Translation from: 1959, 1972, Words of Science and History behind them a More Words of Science, Houghton Miffin Company, Boston. České vydání doplnil a upravil Koryta Jiří.
ATKINS, P. W., 2005, Periodické království: cesta do země chemických prvků, Academia, Praha, ISBN 80-200-1185-4.
BĚHOUNEK, František, 1945, Svět nejmenších rozměrů, Jaroslav Tožička, Praha.
DIENSTBIER, Zdeněk, 2010, Hirošima a zrod atomového věku: cesta od atomových zbraní k nukleární medicíně a jaderným elektrárnám, Mladá fronta, Praha, ISBN 978-80-204-2224-8.
FEYNMAN, Richard Phillips, 2014, Neobyčejná teorie světla a látky: kvantová elektrodynamika, Aurora, Praha, ISBN 978-80-7299-107-5.
FIKR, Jaroslav, 2010, Jak porozumíme chemickým vzorcům a rovnicím, Barrister & Principal, Brno, ISBN 978-80-87029-94-7.
GARLÍK, Bohumír, 2012, Energie elektromagnetického pole, inteligentní budovy a lidský organismus, Energetika, 62(12), ČSZE, Praha, ISSN 0375–8842.
GONZALEZ, F. M., et al., 2021, Improved Neutron Lifetime Measurement with UCNτ, Phys. Rev., 127(16), DOI: 10.1103/PhysRevLett.127.162501.
GRAY, Theodore W., 2012, Prvky: obrazový průvodce všemi známými atomy ve vesmíru, Slovart, Praha, ISBN 978-80-7391-544-5.
HÁLA, Jiří, 1998, Radioaktivita, ionizující záření, jaderná energie, KONVOJ, Brno, ISBN 80-85615-56-8.
HEISENBERG, Werner, 1997, Část a celek: rozhovory o atomové fyzice, Votobia, Olomouc, ISBN 80-7198-216-4.
HESLOP, R., JONES, K., 1982, Anorganická chemie, SNTL, Praha.
HORÁK, Zdeněk. KRUPKA, František, ŠINDELÁŘ, Václav, 1961, Technická fysika, SNTL, Praha.
HOUSER, Pavel, 2019, Nejmenší kousek ledu: stačí jen 90 molekul vody, sciencemag.cz, Nitemedia s.r.o., Praha, [online], [cit. 2021-01-17]. Dostupné z: https://sciencemag.cz/nejmensi-kousek-ledu-staci-jen-90-molekul-vody/.
JUNGK, Robert, 1965, Jasnější než tisíc sluncí: osudy atomových vědců, Mladá fronta, Praha.
KEAN, Sam, 2016, Mizející lžíce, růžový sníh a jiskřící bonbóny: fascinující příběhy o vědě, šílenství a lásce z periodické tabulky prvků, Grada Publishing, Praha, ISBN 978-80-247-5844-2.
KRAUSS, Lawrence Maxwell, 2013, Vesmír z ničeho, Knižní klub, Praha, ISBN 978-80-242-4145-6.
LINSTROM P.J. MALLARD, W.G., Eds., 2018, NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg MD, 20899, [online], [cit. 2018-11-19]. Dostupné z: https://doi.org/10.18434/T4D303.
MACHÁČEK, Martin, 1995, Encyklopedie fyziky, Mladá fronta, Praha, ISBN 80-204-0237-3.
McMURRY, John, 2006, Organická chemie, VUTIUM, Brno, ISBN 978-80-214-3291-8. Translation from: 2004, Organic chemistry, Brooks/Cole a thomson Learning Company, ISBN: 0534389996.